Líquido gelado faz comprimido efervescente borbulhar devagar
Quando estão em temperatura ambiente, as moléculas do comprimido trombam umas com as outras várias vezes.
Por que os comprimidos efervescentes se dissolvem mais rápido em água natural do que em água gelada?
Porque o calor ajuda na reação. O comprimido é formado basicamente por carbonato, bicarbonato de sódio e um ácido. Quando colocadas na água, essas substâncias reagem. Como em qualquer outra combinação química, o calor acelera o processo. “Para que uma reação aconteça, é preciso que as moléculas das substâncias envolvidas se choquem umas com as outras”, explica o químico Atílio Vanin, da Universidade de São Paulo.
Se a água estiver muito fria, o movimento das moléculas será bem menor e a chance delas trombarem também é pequena. À medida que a água esquenta, aumentam as chances da colisão e conseqüentemente a reação passa a ocorrer com maior rapidez.
Bolha pra todo lado
A reação química é acelerada pelo calor da água do copo.
Em contato com a água, as moléculas começam a se chocar, liberando o gás carbônico, que forma as bolhas.
O comprimido é composto por bicarbonato, carbonato de sódio e um ácido.

 SEGUIR
SEGUIR
 SEGUINDO
SEGUINDO

 Orcas são filmadas oferecendo peixes a humanos. É presente ou manipulação?
Orcas são filmadas oferecendo peixes a humanos. É presente ou manipulação?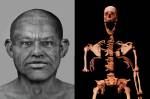 Pela primeira vez, cientistas sequenciam genoma completo de uma pessoa do Egito Antigo
Pela primeira vez, cientistas sequenciam genoma completo de uma pessoa do Egito Antigo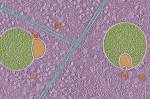 Cientistas descobrem parte nunca antes vista das células humanas
Cientistas descobrem parte nunca antes vista das células humanas A transição demográfica e a longevidade são conquistas históricas
A transição demográfica e a longevidade são conquistas históricas Quais eram os cheiros na Roma antiga? Acredite, bem ruins
Quais eram os cheiros na Roma antiga? Acredite, bem ruins








