EUA rejeitaram vacina que a Pfizer quer aprovar no Brasil
Ela foi desenvolvida contra a Ômicron, mas é baseada na subvariante BA.1, que já está extinta; governo americano exigiu que os novos imunizantes utilizem as subvariantes BA.4 e BA.5, que são as dominantes hoje - e Pfizer e Moderna aceitaram
Ela foi desenvolvida contra a Ômicron, mas é baseada na subvariante BA.1, que já está extinta; governo americano exigiu que os novos imunizantes utilizem as subvariantes BA.4 e BA.5, que são as dominantes hoje – e Pfizer e Moderna aceitaram
A notícia em si, você talvez já tenha visto: na sexta-feira, a Pfizer enviou à Anvisa um pedido de autorização de uso emergencial da sua nova vacina contra o coronavírus. Ela é feita de RNA mensageiro (mRNA), como a vacina atual, mas é bivalente. Ou seja, contém mRNA para ensinar o organismo a fabricar duas versões da proteína spike, os “espetos” que o coronavírus usa para infectar nossas células: tanto a spike original, do Sars-CoV-2 descoberto em 2019, quanto a spike da variante Ômicron.
Dessa forma, o sistema imunológico aprende a reconhecer tanto o coronavírus original quanto a variante Ômicron, e a pessoa fica protegida contra ambas (mais do que com as vacinas atuais). Mas, na prática, há um problema. A nova vacina da Pfizer, assim como o novo imunizante da Moderna, é baseada na primeira Ômicron: a BA.1, que foi suplantada por outras variantes e já está extinta.
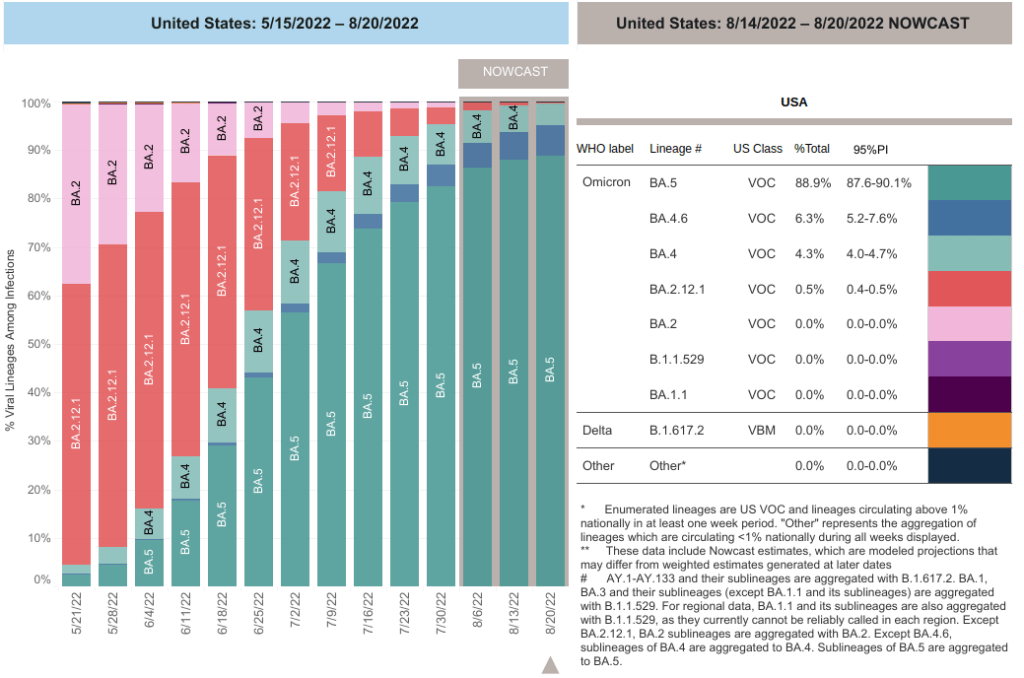
Hoje as subvariantes BA.4 e BA.5 são dominantes, correspondendo a quase 100% dos casos. Ocorre que as novas vacinas, tanto a da Pfizer quanto a da Moderna, são menos eficazes contra elas: produzem 3 vezes menos anticorpos neutralizantes do que contra a BA.1, a subvariante na qual se baseiam.
Por isso, a FDA americana orientou as empresas a reformularem suas novas vacinas, que deverão contemplar as subvariantes BA.4 e BA.5. Elas já estão fazendo isso. Hoje, dia 22 de agosto, a Pfizer enviou à FDA o pedido de liberação da sua vacina BA.4/5.
Mas, ao mesmo tempo, ela continua oferecendo a vacina BA.1 para outros países. O Reino Unido foi o primeiro a aprová-la, em 15 de agosto. Agora, a empresa submeteu o produto à Anvisa. Por que isso está sendo feito, já que a vacina BA.1 foi recusada pelos EUA?
Procurada pela Super, a Pfizer não respondeu a essa pergunta. Caso o faça, este texto será atualizado. Ao anunciar a submissão de sua vacina BA.1 à Anvisa, na sexta-feira, a empresa afirmou que “existe também a possibilidade de submissão, em um futuro próximo, de uma versão atualizada da vacina para as subvariantes BA.4/BA.5”.
Ou seja: a Pfizer até planeja trazer sua vacina mais recente e eficaz para o Brasil. Mas, antes, ela quer comercializar aqui a versão BA.1.
A nova geração de vacinas também tem levantado outra polêmica. Para ganhar tempo, e conseguir aprovar os imunizantes BA.4/5 em setembro, em tempo para uso no inverno americano, a FDA cogita mudar sua política: pela primeira vez, a agência poderá julgar a segurança e a eficácia das novas vacinas se baseando somente em estudos com ratos, dispensando testes em humanos.
Essa possibilidade tem dividido especialistas. Alguns acreditam que tudo bem, pois as vacinas de mRNA já foram bastante testadas – e aplicadas em bilhões de pessoas. Outros entendem que, por se tratar de uma nova fórmula, seria melhor esperar a conclusão dos testes clínicos em voluntários.
Atualização 19h50: A Pfizer enviou uma resposta à Super, na qual afirma o seguinte: “A decisão de submissão regulatória depende das discussões pertinentes com as agências regulatórias de cada país ou região. Em localidades como Reino Unido, União Europeia, Canadá, Japão e Chile também foi submetido o pedido de uso emergencial para a versão adaptada à variante Ômicron BA.1.”


 SEGUIR
SEGUIR
 SEGUINDO
SEGUINDO

 O Cavaleiro dos Sete Reinos: o que você precisa saber sobre o novo spin-off de Game of Thrones
O Cavaleiro dos Sete Reinos: o que você precisa saber sobre o novo spin-off de Game of Thrones Por que os pássaros não peidam?
Por que os pássaros não peidam? Por que falam que a carne de porco é “remosa”?
Por que falam que a carne de porco é “remosa”? Como melhorar seus treinos na academia
Como melhorar seus treinos na academia A história do Vazio de Boötes, o pedaço mais assustador do Universo
A história do Vazio de Boötes, o pedaço mais assustador do Universo


















